一、假设目标蛋白的信息
名称:XXX蛋白
大小:30kDa
缓冲液:PBS
浓度:0.6mg/mL
体积:6mL(3管分装)
标签:仅6Xhis
纯度:90%以上
二、实验过程
1蛋白表达载体的构建
1.1序列二基因序列密码子优化后合成及构建
Optimizedforyourreference:
CATATGxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxCTCGAG
合成时候带上上下游酶切位点分别是NdeI,XhoI(黄色阴影),并克隆到原核表达载体Pet24a载体。
1.2DNA测序
将经菌落PCR鉴定为阳性克隆测序,测序工作由华大基因完成(见附件)。
2构建正确的Pet24a-序列二表达载体在大肠杆菌中的表达
2.1转化至大肠杆菌BL21(DE3)
常规CaCl2法。
2.2IPTG诱导融合蛋白的表达
2.2.1挑取转化平板上的单克隆接种于含50μg/mlKan的3mlLB培养液的试管中,37℃220rpm振摇过夜;
2.2.2次日按1:100接种于50μg/mlKan的30mlLB培养液中,37℃220rpm振摇至菌体OD600为0.4(约2h);
2.2.3取出1ml培养物,12000g室温离心2min,弃上清,用100μl1×上样缓冲液重悬菌体沉淀;
2.2.4向剩余的培养物中加入IPTG至终浓度为0.5mmol/l,37℃220rpm振摇4h,诱导序列二蛋白表达;
2.2.5取出1ml培养物,12000g室温离心2min,弃上清,用100μl1×上样缓冲液重悬菌体沉淀,剩余培养物4℃4000g离心12min,弃上清,沉淀置-20℃冻存。
2.3表达产物分布的确定
2.3.1将表达菌体重悬于400μlNi-IDABinding-Buffer(20mMTris-HCl,5mM咪唑,0.5MNaCl,);
2.3.2重悬液进行超声波破碎(冰浴中进行):功率100W,工作4sec,间歇8sec,共10min;
2.3.3超声破碎液4℃12000g离心20min,取10μl上清液加入等量的2×上样缓冲液,沉淀用400μl1×上样缓冲液重悬后取5μl,恒压150V进行12%SDS-PAGE,考马斯亮蓝R250染色显带。
3融合蛋白的纯化
3.1将1L诱导表达的培养菌体沉淀用20mlNi-IDABinding-Buffer重悬后,超声破碎(功率200W,工作4sec,间歇8sec,共20min),4℃12000g离心20min,取上清;
3.2利用BiologicLP层析系统,上清液以0.5ml/min流速上样至Ni-IDABinding-Buffer预平衡的Ni-IDA-SepharoseCL-6B亲和层析柱;
3.3用Ni-IDABinding-Buffer以0.5ml/min流速冲洗,至流出液OD280值到达基线;
3.4用Ni-IDAWashing-Buffer(20mMTris-HCl,30mM咪唑,0.5MNaCl,)以1ml/min流速冲洗,至流出液OD280值到达基线;
3.5用Ni-IDAElution-Buffer(20mMTris-HCl,250mM咪唑,0.5MNaCl,)以1ml/min流速洗脱目的蛋白,收集流出液;
3.6进行12%SDS-PAGE分析。
三、实验结果
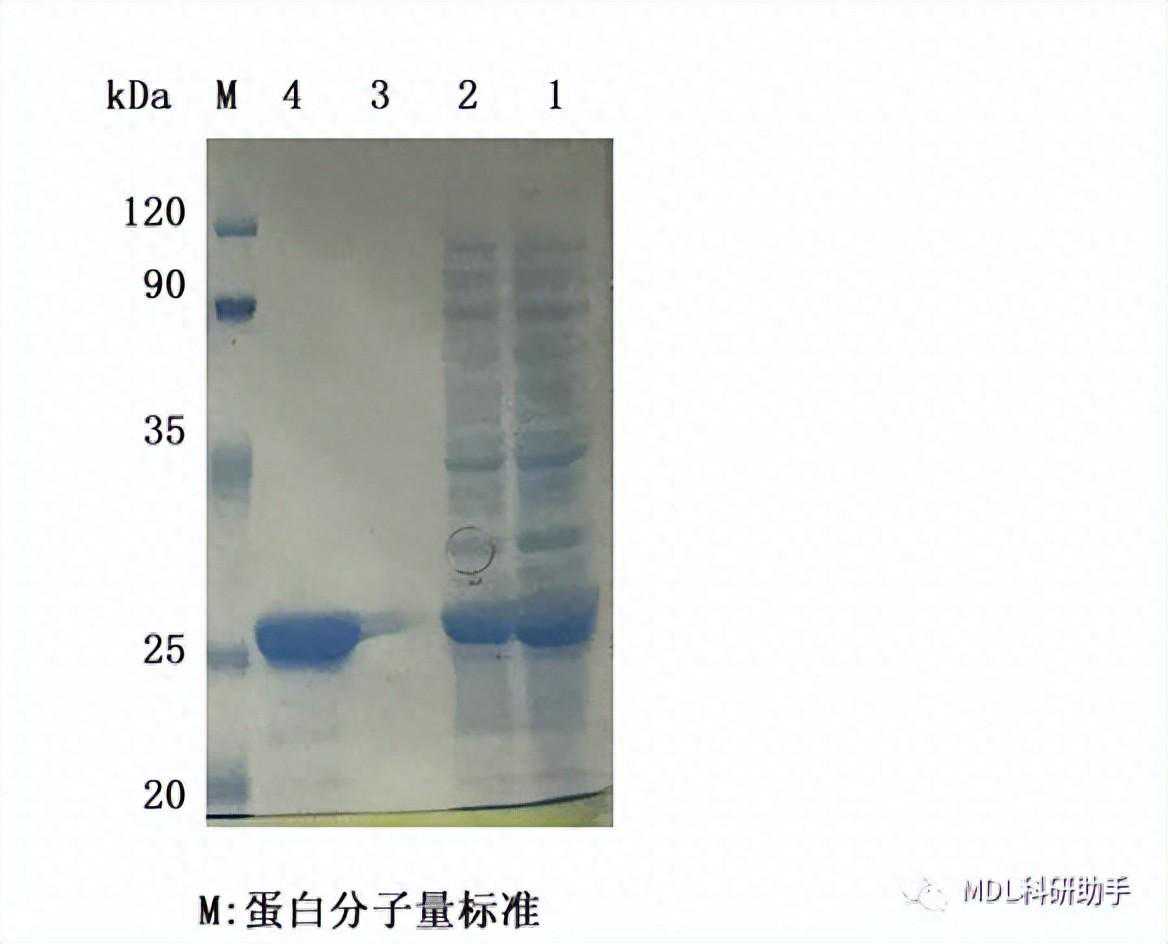
SDS-PAGE结合考染鉴定纯化的XXX蛋白
1-4泳道分别指XXX蛋白放大表达后的全菌、破碎上清、纯化时20mM咪唑洗脱液以及250mM咪唑洗脱液。



