*前往“纳米酶Nanozymes”公众号,了解有关纳米酶的最新消息!
*本文首发于“纳米酶Nanozymes”公众号,2022年2月27日

实体肿瘤中的高H2O2、乏氧和酸性环境使得肿瘤对放疗、化疗和光动力治疗等产生耐药性或低敏感性。通过调节肿瘤微环境中的氧气和ROS的水平可能会增强抗肿瘤治疗的效果。纳米酶可以通过OXD或POD活性产生ROS来诱导氧化应激杀伤肿瘤细胞,也可以通过CAT活性在肿瘤微环境中催化H2O2分解产生O2,缓解肿瘤组织乏氧,间接诱导肿瘤细胞死亡。
中南大学陈万松课题组在《大学化学》杂志上发表了题为《纳米酶在抗肿瘤治疗中的应用》的综述,介绍了纳米酶用于肿瘤治疗的三种方式:缓解肿瘤乏氧、产生ROS进行肿瘤催化治疗和肿瘤免疫治疗。首先,缓解肿瘤乏氧,即通过纳米酶的CAT活性,将H2O2催化分解为O2,不仅可以消耗肿瘤微环境中的H2O2,还可以协同其他光、声和化学动力治疗进行肿瘤治疗。例如,黑磷(BP)纳米片上的Pt纳米粒具有类过氧化氢酶活性,从而可以有效分解肿瘤中积累的H2O2产生O2,缓解肿瘤乏氧,期间生成的O2可以提高BP纳米片的光动力抗肿瘤活性,即增加生成的1O2浓度进而引起肿瘤细胞凋亡(如图2所示)。其次,产生ROS进行肿瘤催化治疗,即通过纳米酶的类POD或OXD活性将H2O2或O2催化转化产生ROS,从而诱导肿瘤细胞死亡。例如,金纳米颗粒与多孔空心碳纳米球(Au@HCN)结合形成的纳米酶可以在酸性条件下通过OXD和POD活性产生ROS,协同光热治疗可以破坏肿瘤组织(如图3所示)。最后,肿瘤免疫治疗,即通过纳米酶诱导M2型巨噬细胞向M1型巨噬细胞极化,改善肿瘤免疫微环境,并且通过纳米酶催化反应和免疫治疗实现对肿瘤的治疗。例如,Cu2-xTe纳米颗粒具有谷胱甘肽氧化酶和过氧化物酶活性,能够同时消耗肿瘤组织中的谷胱甘肽和过氧化氢产生·OH和O2·-。该纳米酶的级联催化反应,能够促进巨噬细胞由M2型向M1型极化,有效产生抗肿瘤免疫(如图4所示)。
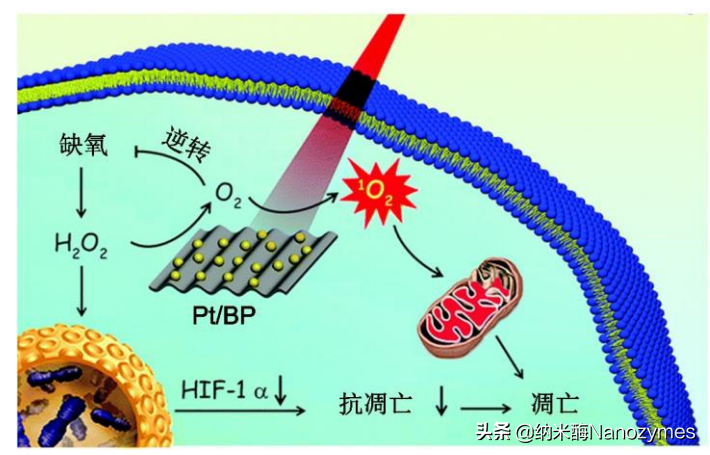
图2Pt纳米酶负载黑磷(BP)纳米片用于
肿瘤光动力治疗[1]
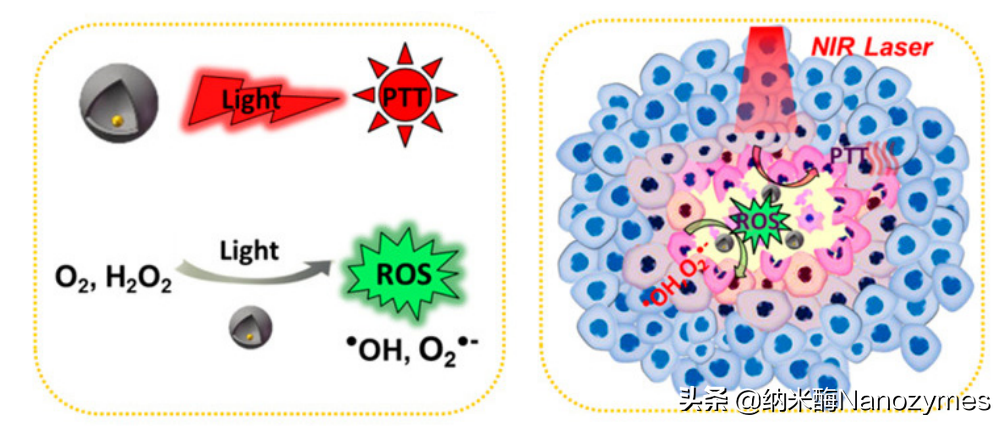
图3Au@HCN纳米酶协同光热治疗用于
抗肿瘤治疗[2]
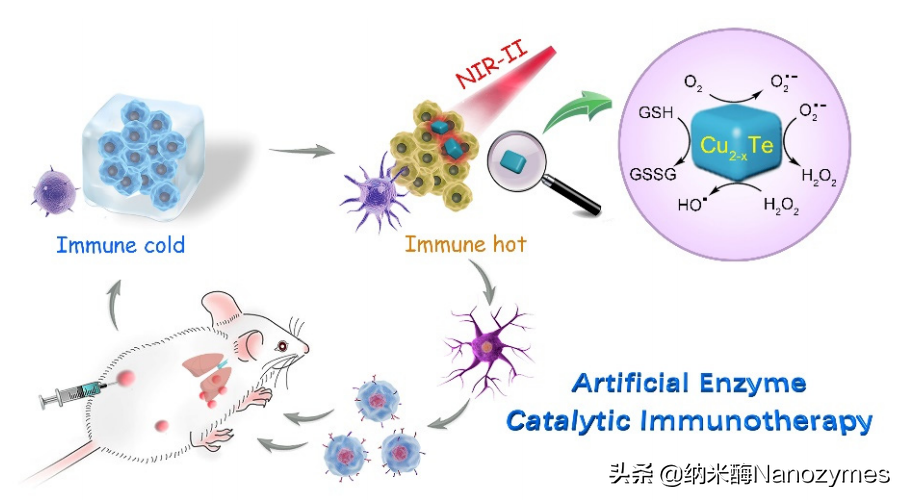
图4Cu2-xTe纳米酶用于促进巨噬细胞由M2型
向M1型极化及激活抗肿瘤免疫[3]
最后,作者还指出了纳米酶在临床应用前还有一些问题亟待解决。除了要设计和优化具有高底物选择性和催化效率的纳米酶,还需要制定有效的策略来提高纳米酶的靶向性。同时,纳米酶的生物安全性及治疗机理仍需要进一步研究,进而使其有望从实验室走向临床,真正应用于人类肿瘤治疗。
参考文献:
[1]Ouyang,J.;Deng,Y.;Chen,W.;Xu,Q.;Wang,L.;Liu,Z.;Tang,F.;Deng,L.;Liu,,6,2057.
[2]Fan,L.;Xu,X.;Zhu,C.;;Gao,L.;Xi,J.;Guo,,10,4502.
[3]Wen,M.;Ouyang,J.;Wei,C.;Li,H.;Chen,W.;Liu,,58,17425.
往期推荐
|具备两种类酶活性的的无定型MOF纳米酶
|肿瘤微环境激活的ROS放大器用于多模式协同治疗肿瘤
|催化合成的普鲁士蓝纳米酶
撰稿:赵婧媛
审阅:张益宏



