
实验室基础知识是每一位实验室工作者必须掌握的,这是成为一个合格实验员的前提。今天小编就把实验室这些必须掌握的基础知识做了一个梳理、总结。
小伙伴们,快来测一测,你是不是一名合格的实验员。
器皿1.玻璃器皿的分类
(1)容器类:
用以贮存或运输液体或气体,以及在其中进行化学反应的各种玻璃器皿。如:试剂瓶、烧杯、烧瓶(锥形、球形)、试管、比色管等。容器类玻璃器皿的原料有软质玻璃(不可加热)和硬质玻璃(可加热),在使用时应加以注意。
(2)量器类:
用以计量液体体积的玻璃器皿。量器的制作原料是白玻璃(软质玻璃),不宜加热。量器分为量入式和量出式。量入式:只有量瓶和具塞量筒两种,主要用于定容。量出式:如滴定管、吸管、量筒、量杯等。
a.量筒和量杯:用于量取要求并不精确的液体体积,例如配制百分浓度,体积比的浓度等的溶液。量筒的容量允许误差大致相当它的最小分度值。
b.量瓶:全称单标线容量瓶,用于配制标准溶液和定容实验,是精确的量入用量具。量瓶是细长颈薄壁的平底容器,瓶颈上刻有一条环型标线,瓶壁标有容积及其检定时的温度。
c.吸管:又称移液管,是做精确量出用的量具,有分度吸管和单标线吸管两种。
d.滴定管:容量分析中的基本测量仪器,有常量和微量两个等级。在使用上分为酸式(具塞)和碱式(不具塞)两大类。
(3)其他常用玻璃器皿
a.冷凝管:在蒸馏和回流中把蒸汽冷凝成液体。分类:蛇形、球形、直形、空气冷凝管。
注意:使用时冷却水管接下口,出水管接上口,不得接反。
b.干燥器:存放烘干的样品、试剂、称量瓶等,保存需要防潮的小型仪器。
注意:盖口磨砂玻璃平面涂以凡士林,打开盖子时只能推开,不能揭开。长期不用打不开时,可用热毛巾捂热再开。
c.漏斗:普通玻璃漏斗、砂芯漏斗、分液漏斗。
2.玻璃器皿的洗涤
玻璃仪器清洁与否能直接影响实验结果的准确性和精密度,因此,应十分重视玻璃仪器的洗涤。
实验室中常用肥皂、洗涤剂、洗衣粉、去污粉、洗液、和有机溶剂等清洗玻璃仪器。肥皂、洗涤剂等用于清洗形状简单、能用刷子直接刷洗的玻璃仪器,如烧杯、试剂瓶、锥型瓶等;洗液主要用于清洗不易或不应直接刷洗的玻璃仪器,如吸管、容量瓶、比色管等。此外也可用洗液洗涤长久不用的玻璃仪器以及刷子刷不下的污垢,利用它与污物起化学反应,氧化破坏有机物而除去污垢。
(1)常用洗液的配制和使用
a.铬酸洗液:是实验室的传统洗液,由重铬酸钾和浓硫酸配制而成,有很强的氧化能力,对玻璃的侵蚀作用小,洗涤效果好,但六价铬能污染水质,应注意废液的处理。
配制方法:称20克工业品重铬酸钾置于40毫升水中加热溶解,放冷。缓缓加入360毫升工业浓硫酸(注意不能将重铬酸钾溶液加入硫酸中),边加边用玻璃棒搅拌,因二者混合时大量放热,故硫酸不可加得太快,以防因剧烈放热而发生意外。配好后放冷,装入有盖的玻璃器皿中备用。
b.碱性高锰酸钾洗液:这种洗液作用缓慢温和,可洗涤有油污的器皿。
配制方法:取4克高锰酸钾溶于80毫升水中,再加50%氢氧化钠至100毫升。使用这种洗液后如玻璃器壁沾有褐色氧化锰,可用盐酸或草酸洗除。碱性高锰酸钾洗液不应在器皿中长期存留。
c.纯酸洗液:如1+1盐酸、硫酸,10%硝酸等。
d.纯碱洗液:如10%以上的氢氧化钠、氢氧化钾、碳酸钠等。
e.有机溶剂:沾有较多油脂性污物的玻璃器皿,尤其是难以使用毛刷刷洗的小件或形状复杂的玻璃仪器,如活塞内孔、吸管和滴定管的尖头等,可用汽油、甲苯、二甲苯、丙酮、酒精、氯仿等有机溶剂浸泡或搽洗。
(2)洗涤方法
a.常规洗涤法洗涤玻璃仪器之前,应先用肥皂洗净双手。一般玻璃仪器经自来水冲刷去灰尘后,用毛刷蘸热肥皂液(洗涤剂等)仔细刷净内外表面,尤其应注意容器的磨砂部分和器口边缘处,边用水冲边刷洗至无肥皂液,再用自来水冲洗3~5次,用蒸馏水充分荡洗3次。洗净的玻璃仪器壁上应能被水均匀湿润(不挂水珠)。玻璃仪器经蒸馏水冲洗后,残留的水分应为中性。
洗涤中应按少量多次的原则用水冲洗,每次充分振荡后倾倒干净。凡能使用刷子刷洗的玻璃仪器,都尽量用刷子蘸肥皂液刷洗。
b.不便刷洗的器皿根据不同污垢的性质,选择不同的洗液浸泡或共煮,然后再按常法用水冲洗。
c.水蒸汽洗涤主要用于成套仪器,如酚、氰蒸馏装置,凯氏氮装置等。也可用蒸馏瓶制成简易水蒸汽洗涤装置。
d.特殊的清洁要求比色皿的清洗:不得用铬酸洗液洗涤;用酸浸泡时间不得过长;洗后应晾干,不得烘干;比色有机溶液(如测砷、挥发酚)后应用有机溶剂清洗,若用水洗需晾干后使用。测定金属用的器皿需用稀硝酸浸泡,再用水清洗。
测定铬的器皿不得用铬酸洗液洗涤。测定磷的器皿不得用洗衣粉等含磷洗涤剂洗涤。
(3)玻璃器皿的干燥
控干:用滴水架或专用柜;
烘干:用干燥箱(量器不得使用);
吹干:用电吹风,热风或冷风;
烤干:用酒精灯或红外线灯(只适用硬质玻璃);
详见《水质样品的保存和管理技术规定》HJ493-2009
3.量器的检定
玻璃量器的真实容量并不与其出厂的标注容量完全相符,因此,在分析工作开始之前,尤其是对精密度要求较高的分析工作,必须对所用量器进行容量检定。
(1)量器的等级根据量器的精度(容量的允许误差)和流出时间,分为A、B两级。
a.精度(容量的允许误差):
量器的实际容量与标称容量在限定的范围内的差值,见表1和表3。
b.流出时间:
流出时间是指量出式量器充满液体至标线后,按规定方式排出全部水量所需的时间,见表2和表4。
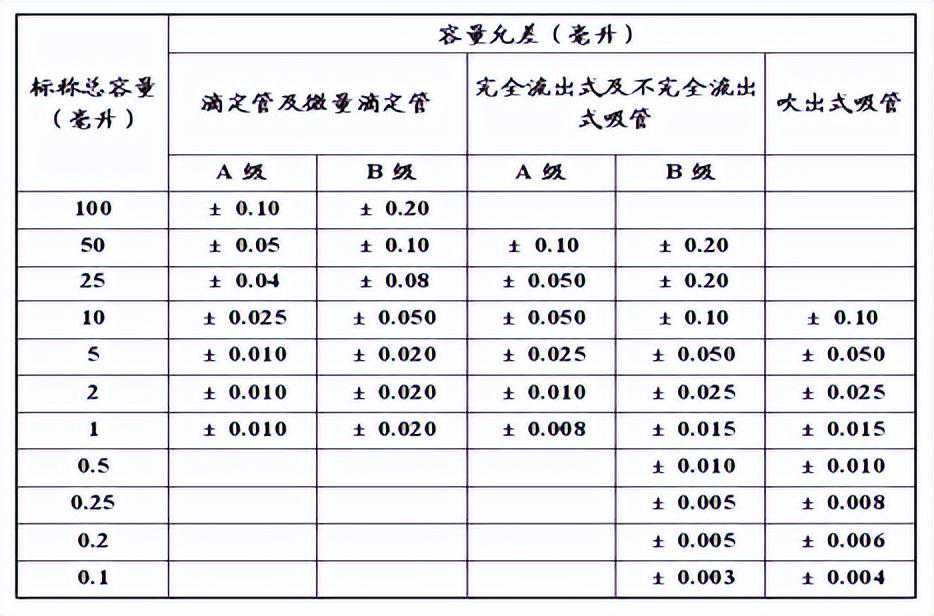
表1标准温度20℃时全量和零至任意分量的容量允许差表
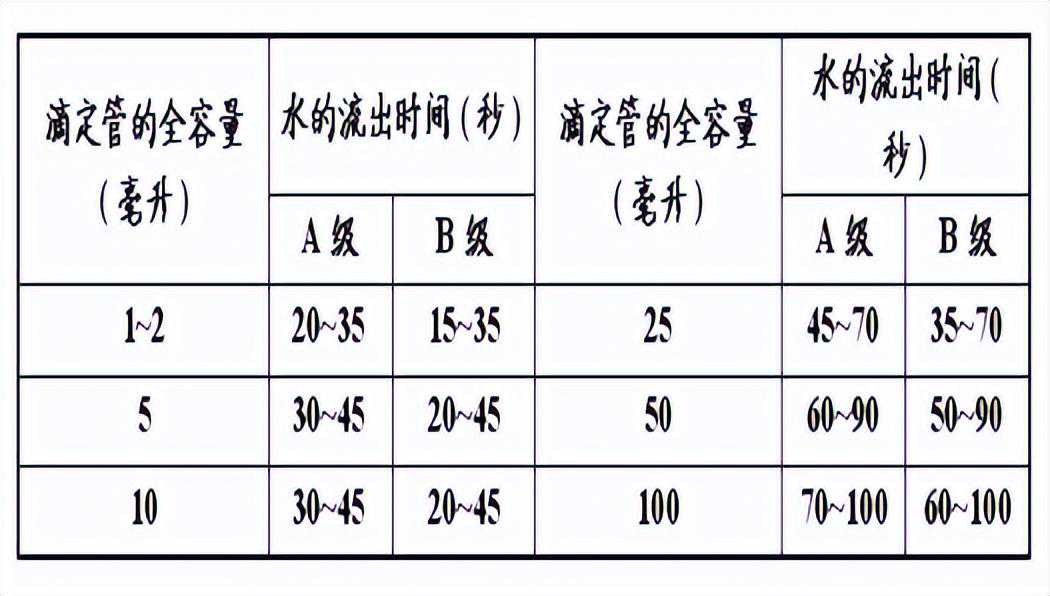
表2滴定管的流出时间表
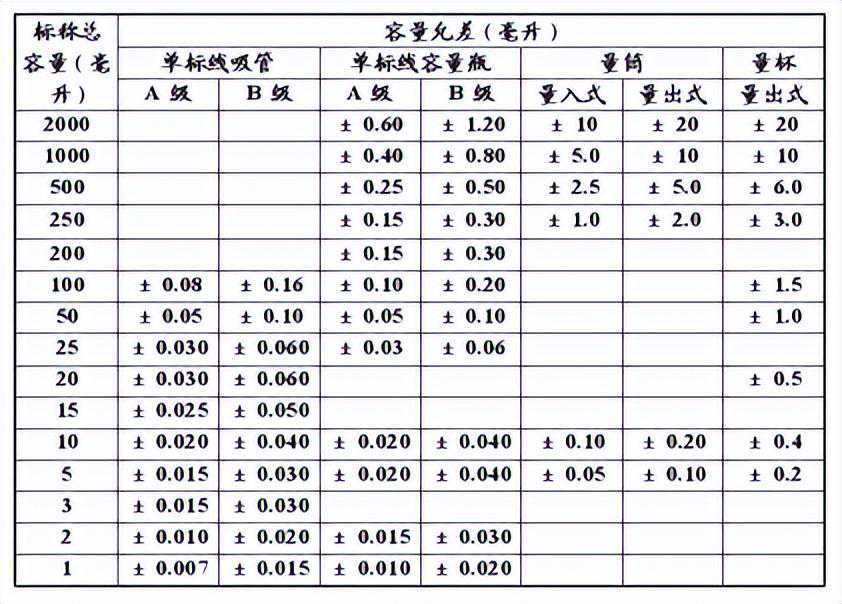
表3标准温度20℃时标称容量允差表
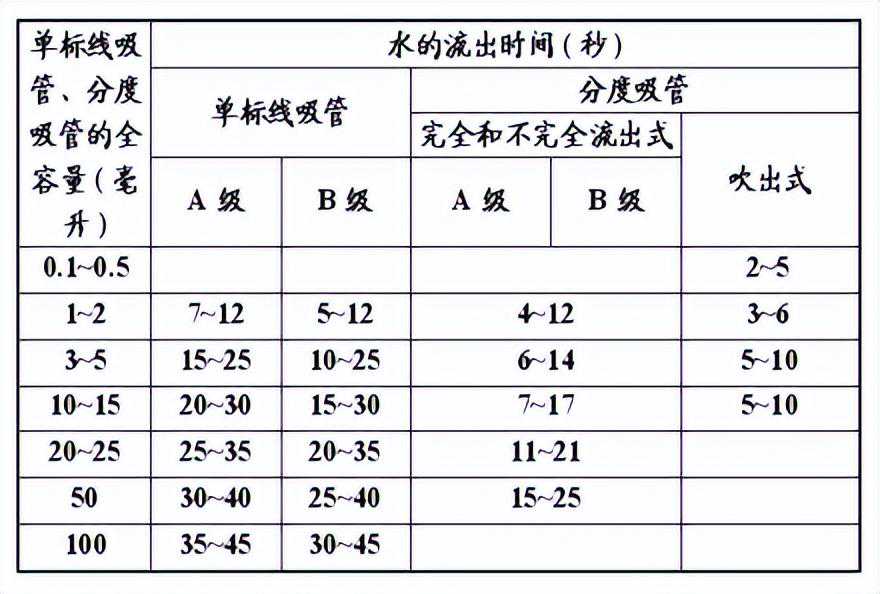
表4吸管的流出时间表
(2)量器的校准
a.测量法(衡量法)
称量量器某一刻度内放出或容纳的纯水重量,并同时记录水温,然后将重量换算为体积:Vt=Wt/dt①式中:Vt——在t℃时纯水的体积;Wt——在t℃时的空气中,以黄铜砝码称得水重;dt——在t℃时的空气中,纯水的密度将任意温度下水的重量换算成体积单位时,需要考虑三个因素:①温度改变,水的密度随之改变;②物体由于空气浮力致使重量改变;③温度改变,玻璃量器热胀冷缩引起容积的改变。
一般量器是指20℃时的容量,温度变化而引起的容量变化是相对20℃时的容量而言,此变化可由下式计算:
Vt=V20+V20(t-20)×0.000026/℃………②
式中:0.000026是钠钙玻璃膨胀系数将②代入①,得:
V20+V20(t-20)×0.000026/℃=Wt/d
V20=Wt/dt【1+(t-20)×0.000026/℃】③
令:γ=dt[1+(t-20)×0.000026/℃]
则:V20=Wt/γ④
④式中的γ,表示在不同温度下,以水充满20℃时容量为1升的玻璃量器,于空气中用黄铜砝码称得的水重。γ值可以通过查表得出。
用①式可以测量量器在不同温度下的实际容量;
用④式可以确定量器的等级。
b.比较法
此法较方便实用,对于要求不太高的试验可采用此法,可减少偶然误差。如用己校准过的吸管校正一系列比色管或量瓶。
4.量器的使用规则
(1)标准溶液的配制、量取和稀释等操作,应以A级无分度吸管与A级容量瓶配套使用。
(2)水样的量取和稀释的操作,应以A级或B级无分度吸管与A级或B级容量瓶配套使用。
(3)一般试剂的量取可使用刻度吸管或量筒。
(4)不得将容量瓶作量出式量器使用。
(5)不得将比色管作为量器用以定容和稀释等操作,若需在比色管内定容,则应将一列比色管用比较法校准。
(6)滴定管的选用应以用量消耗不超过2/3为宜。不得使用大容量滴定管连续滴定多份试样,也不宜使用小容量滴定管多次充液滴定同一试样。
化学试剂1.规格和用途
(1)一般试剂
常见的化学试剂分为四种规格:
a.优级纯(绿色瓶签)为一级品,又称保证试剂,主要成分含量高,杂质少,用于精确分析和研究工作,有的还可作基准物质。
b.分析纯(红色瓶签)为二级品,质量略低于优级纯,用于一般分析和科研。
c.化学纯(蓝色瓶签)为三级品,质量较分析纯差,用于工业分析及教学实验。
d.实验试剂(棕色瓶签)为四级品,杂质含量较多,主要用于一般化学实验。
(2)高纯试剂
质量品级高于一级品的高纯试剂,目前国际上尚无统一的明确规格,国内通常用9表示产品的纯度,在规格栏中标以2个9、3个9、4个9等。
(3)其他规格的试剂
如色谱纯试剂、光谱纯试剂、生化试剂、生物染色剂等。
2.使用和保存
(1)使用使用化学试剂必须遵守以下原则。
a.使用化学试剂前应检查试剂的外观,注意其生产日期,不能使用失效的试剂。如怀疑有变质可能,应检验合格后再用。使用中要注意保护瓶上的标签,如有脱落应及时贴好,如有损毁应照原样补全并贴牢。
b.取用液体试剂只准倾出使用,不得在试剂瓶中直接吸取,倒出的试剂不得再倾回原瓶中。倾倒液体试剂时应使瓶签在上方,以免淌下的试剂沾污或腐蚀瓶签。
c.取用固体试剂时应遵守“只出不回,量用为出”的原则,倾出的试剂有余量者不得倒回原瓶。所用牛角匙应清洁干燥,不允许一匙多用。
(2)保存
a.分类摆放。化学试剂较多时,应按各种试剂的化学性质分类保管。性质稳定的固体盐类可按阳离子或阴离子分类,分开摆放,取用后及时放回原处。
b.剧毒试剂如氰化钠(钾)、氧化砷、汞盐等应贮存于保险柜中,并有专人保管。
c.易挥发试剂应贮放在有通风设备的房间里。
d.易燃易爆试剂应贮存于安全柜或砂箱中。
(3)影响试剂变质的因素:
a.空气
空气中的氧、二氧化碳、水分、纤维和尘埃都可能使某些试剂变质。化学试剂必须密封贮于容器内,开启取用后应立即盖严,必要时应加蜡封。
b.温度
试剂变质的速度与温度的高低有密切的关系。必须根据试剂的性质选择保存的环境温度。
c.光
日光中的紫外线能使某些试剂变质。一般要求避光的试剂,可装在棕色瓶内,属于必须避光的,在棕色瓶外还要包一层黑纸。
d.杂质
试剂的纯度对其变质情况的影响不容忽视,贮存和取用这类试剂时应特别注意防止杂质污染。
e.贮存期
不稳定的试剂在长期贮存中能发生歧化、聚合、分解或沉淀变化。这类试剂最好分次少量采购贮存。使用前如怀疑其可能变质,应经检验合格后再用。对变质试剂可通过提纯或精制以提高质量,否则应废弃不用。
3.实验用水
国家标准GB6682—2008“实验室用水规格”中明确规定了实验室用三个等级净化水的规格和相应的质量检验方法,应根据实验工作的不同要求选用不同等级的水。
(1)实验室用水的质量要求
a.外观
实验室用水应为无色透明的液体,其中不得有肉眼可辨的颜色及纤絮杂质。
b.等级
一级水基本上不含有溶解杂质或胶态离子及有机物。可用二级水进一步处理制得,如用石英蒸馏器再蒸馏、离子交换柱混合床等方法处理。
一级水用于制备标准水样或超痕量物质的分析。
二级水常含有微量的无机、有机或胶态杂质。可用蒸馏、反渗透或离子交换法制得的水进行再蒸馏的方法制备。用于精确分析和研究工作。
三级水适用于一般分析工作。可用蒸馏、反渗透或离子交换等方法制备。
c.质量指标
实验室用水应符合表1的规定。
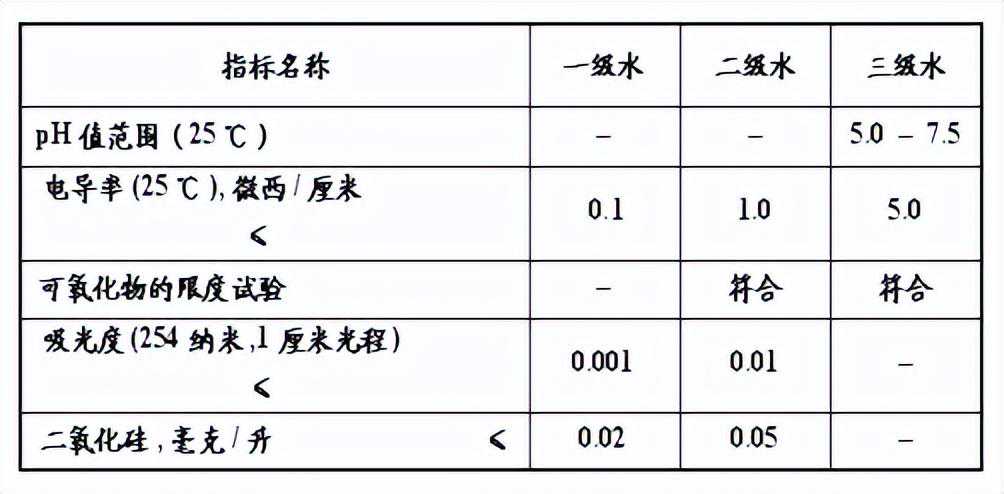
表1实验用水的质量标准
d.贮存
实验用水在贮存中沾污的主要原因是容器的可溶成分的溶解或吸收空气中的二氧化碳和其他杂质。所以,一级水尽可能现制,不贮存。二级水和三级水经适量制备后,可盛装在预先经过处理并用同级水充分清洗过的、密闭的聚乙烯容器中,贮存于空气清新的洁净实验室内。
(2)实验用水的质量检验
值测定
b.电导率测定
c.可氧化物检验
取1000毫升二级水(100毫升三级水)注入烧杯中,加入10.0毫升1摩尔/升硫酸溶液和1.0毫升C(1/5KMnO4)=0.01摩尔/升高锰酸钾溶液,盖上表面皿,煮沸5分钟,与置于另一相同容器中的不加试剂的等体积水样作比较,溶液所呈淡红色不得完全褪尽。
d.吸光度测定
将水样分别注进1厘米和2厘米的石英比色皿中,在紫外分光光度计上,于254纳米处以1厘米比色皿中的水为参比,测定2厘米比色皿中水的吸光度,按表1指标进行判别。
e.二氧化硅测定
(3)实验用水的制备
a.蒸馏水
有金属蒸馏器、玻璃蒸馏器和石英蒸馏器等几种类型。
b.去离子水
用离子交换树脂处理原水,所获得的水称为去离子水或离子交换水。其原理是当原水通过离子交换柱时,水中的K+、Na+、Ca2+、Mg2+等阳离子被阳离子交换树脂所吸附,树脂上的H+被交换到水中;水中的SO42-、Cl-、HCO3-、HSiO3-等阴离子被阴离子交换树脂所吸附,树脂上的OH-被置换到水中,与H+结合生成H2O。
此法能去除水中绝大部分盐类、碱和游离酸,但不能完全去除有机物和非电解质,并常含有微量树脂浸出物和树脂崩解微粒。
去离子水制备方法
1、离子交换树脂的处理与再生
a、新树脂的处理
b、离子交换树脂的再生
2、离子交换装置(交换床)
a、复合床
b、混合床
c、联合床
3、去离子水制备注意事项
a、原水含余氯高时,应除氯后再入柱制水。
b、原水硬度高时应作预处理,以延长交换柱的工作周期。
c、间歇制水后,最初出水质量较差。
d、制得纯水接触空气后,电阻率迅即下降。
c.电渗析法
操作简单,使用方便,但价格较高,不适应基层实验室。
d.特殊要求的实验用水
不含有机物的水:加碱性高锰酸钾溶液再蒸馏。对水要求不高的项目可直接用蒸馏水。
不含CO2的水:将蒸馏水或去离子水煮沸10分钟或通入纯氮处理。
不含酚的水:加入NaOH至pH11,使水中的酚生成不挥发的酚钠再蒸馏或用活性碳吸附。
不含氨的水:加入H2SO4至pH2,使水中的氨或胺都转变成不挥发的盐类,再蒸馏。
其他特殊要求的水按照分析方法要求制备。
这些知识你收藏了吗?下期我们继续哦~



