固定化金属离子亲和层析(IMAC)现在算是蛋白亲和层析中的主要技术了。主要是操作比较简单,纯化比较容易。所以首次接触蛋白纯化实验者,很多是从6His这一连续的组氨酸肽标签开始的。
基本原理
蛋白质中的组氨酸、半胱氨酸和色氨酸侧链能够与过渡金属(Cu2+、Ni2+、Co+、Zn3+等)相互作用,而通过鳌合配基亚氨基乙二酸(IDA),金属离子得以固定,从而使这一氨基酸侧链的特性可以用来纯化蛋白质。经过一系列的学者的研究推进,最终形成6个组氨酸作为融合肽段来纯化蛋白质的经典方法。
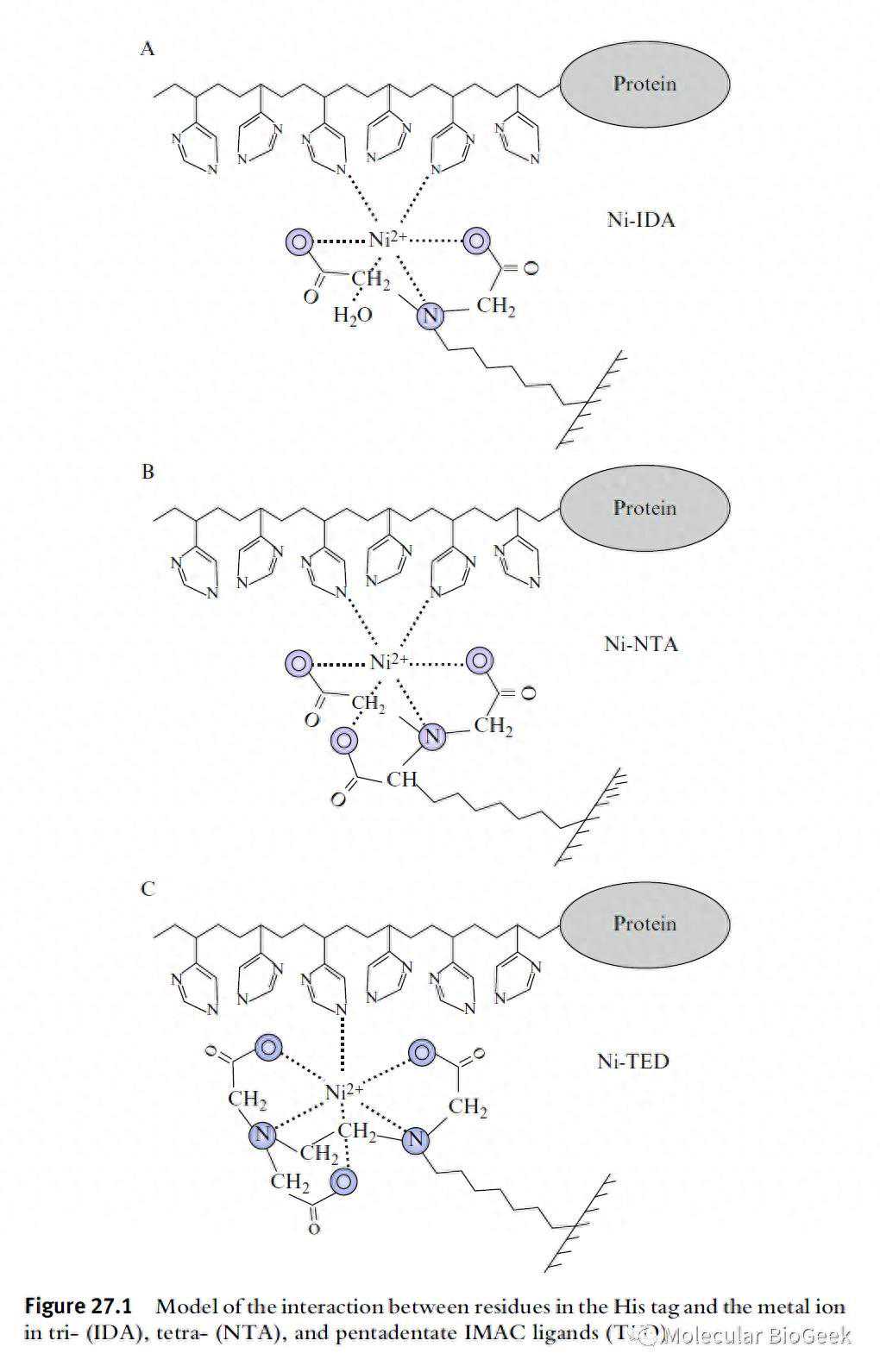
基本操作
蛋白质在中性条件下(),吸附到固定化的金属离子上的能力通常不受高离子浓度的影响。实际上,在缓冲液中经常加入0.1-1MNaCl以减少非特异性静电相互作用。
缓冲液中,磷酸盐、Tris、硼酸盐、HEPES和乙酸盐缓冲液都可行。常用的缓冲液浓度为20-100mM,非离子型表面活性剂、尿素、盐酸胍等不影响IMAC对组氨酸的吸附作用。
实际使用过程中,还原剂不推荐加入,因为还原剂可能会造成金属离子的剥落。如果必须使用,则应在较低的浓度,如DTT不宜超过1mM。
实验流程
在此提供一个基于原核表达的实验流程:
大肠杆菌经发酵培养后,通过8000rpm离心5-8min,收集菌体。使用适量的LysisBuffer(此处推荐Qiagen的NPI-10的采用超声波破碎。
破碎后的裂解液经过1200rpm,4℃离心15-20min,取上清(假设目标蛋白没有形成包涵体)。
经过0.45um或者0.2um滤膜过滤,过滤液经过Ni-NTA填料柱吸附。此处操作步骤针对手工操作纯化柱的情况,如果使用AKTA或等效的蛋白纯化系统,则这些步骤太具有参考意义,在此更多考虑初学者来编写这个流程。
使用NPI-10溶液2-5CV体积洗涤层析柱,如果要求不高,就可立即使用含高浓度咪唑的NPI-500洗脱蛋白。但如果要求较高纯度的蛋白,或者后续不再有其他纯化方法进一步提高蛋白纯度,可使用系列梯度浓度的咪唑对层析柱进行洗涤。该操作可将结合不太牢固的非目标蛋白洗脱,而目的蛋白仍能吸附于Ni-NTA上。
对洗脱的含目的蛋白的溶液进行脱盐处理,如没有专门的脱盐层析柱,透析是一个更为易得的脱盐方法。
注:关于LysisBuffer和ElutionBuffer以及透析Buffer,可参考前面文章。
关于His标签的问题
标签序列
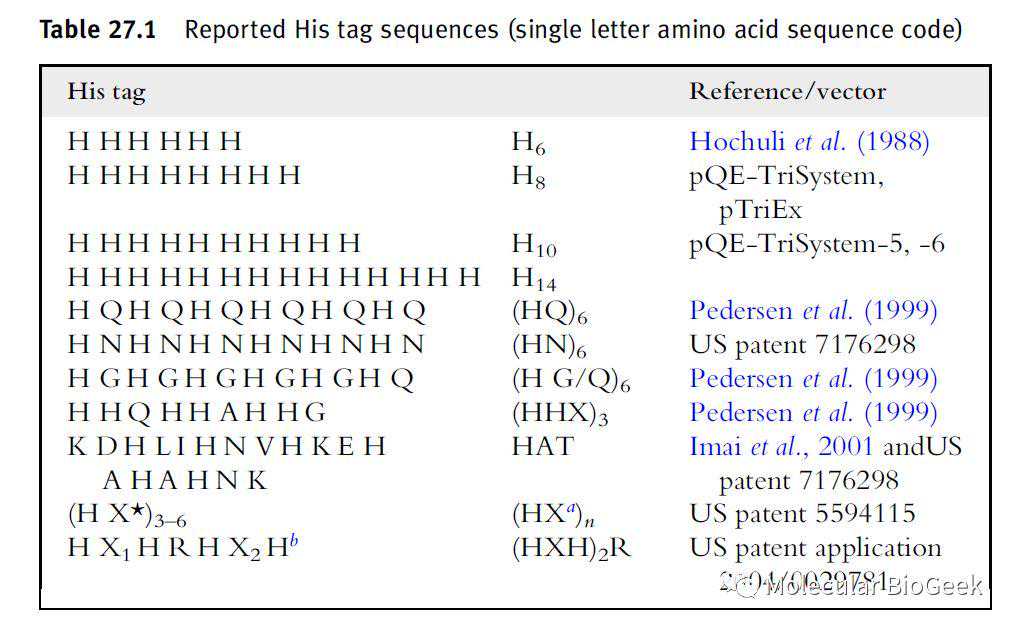
六个His最为经典,我们常见的pET载体内的His标签一般也是6个His。当然也有8个(Qiagen的pQE载体)甚至14个His的,也有间隔His的,详见下图。以MP的经验,6His足够了,在His标签的序列和长短耗费精力对初学者没有多少必要。
His-标签在N端还是C端?
组氨酸标签通常加在蛋白质的两端以增加其暴露,避免被折叠藏在蛋白结构域内部。但是,将His标签放于蛋白N端还是C端,尚无明确的结论,两者均有利有弊。通常,无论是放在哪一端都不太会明显影响蛋白表达。以MP个人经验,对于初学者,大多数人只用IMAC来纯化他们的目的蛋白,而克隆自基因甚少进行密码子优化以适应表达宿主,于是就有可能在翻译过程中会有提前终止的“不完全体”蛋白,在这种情况下,为了蛋白的纯度考虑,MP推荐使用C端His,因为,凡是带有His标签的蛋白必然是完整的序列,而N-段His标签就不能保证这一点。
进一步的信息:
现在常见的IMAC所使用的多是Ni固定在交联琼脂糖的球状颗粒上,ThermoFisher也有Co离子的填料出售。GE和Biorad,Qiagen,ThermoFisher都提供IMACResin,这些树脂通常保存在20%乙醇溶液中,且价格不菲,大约均在100元人民币/mL。国产厂家可能会便宜些,常见的有上海博格隆,常州天地人和等。
树脂填料的价格还与颗粒的大小有关,通常颗粒越小,价格越高,分辨率也越好。至于吸附能力,Qiagen家的Ni-NTAAgarose声称为5-10mg/mL,而GE的NiSepharose则有40mg/mL的结合能力。
至于树脂的流速与耐压能力,就不在此详述了。感兴趣的小伙伴可去下载说明书阅读一下。
参考文献:
1.,,2ndEdition,2009.
2.:ALaborartoryManual.
3.AffinityChromatography,:



