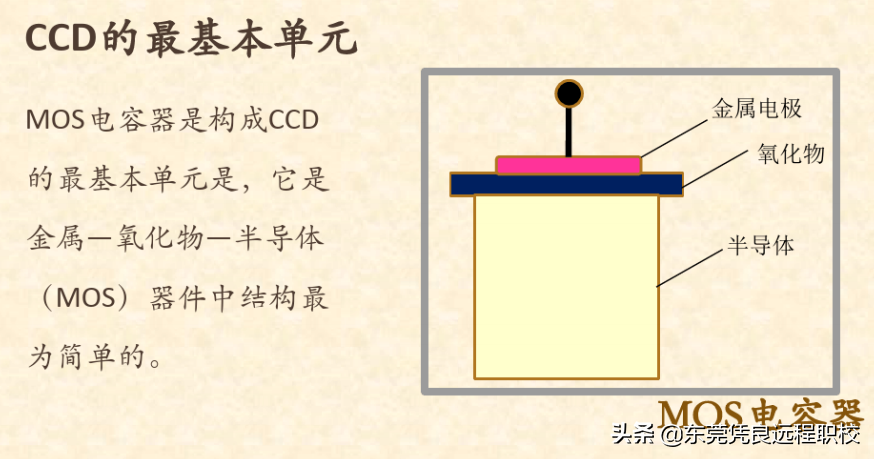
查法(Sterilitytests),顾名思义就是检查是否无菌,至于检查什么,凡是药典要求无菌的药品、医疗器具、原料、辅料等均需要经过此项检查,因此它也成为制药行业绕不过去的一个话题。
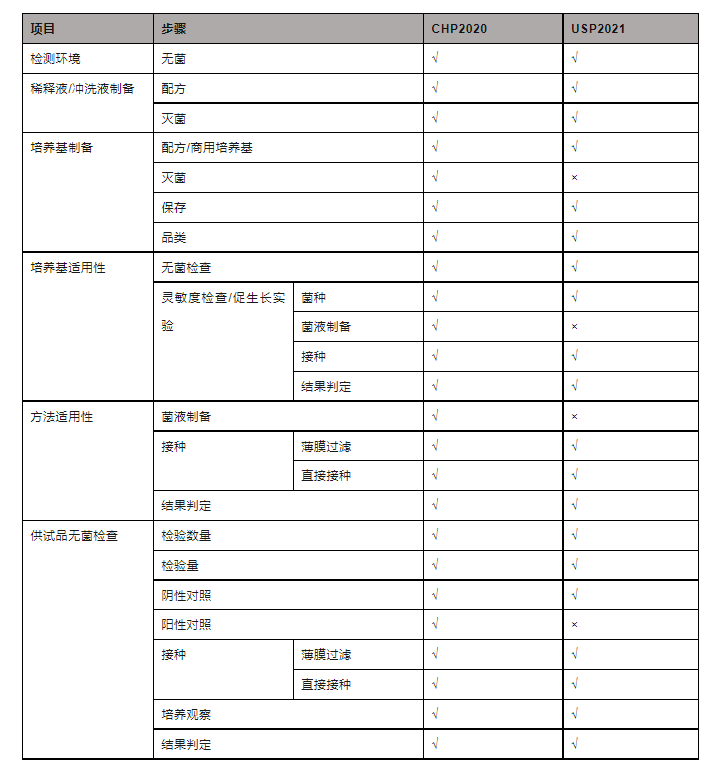
一、认识无菌检查法除去培养基制备、储存和稀释液、冲洗液配制等准备工作,无菌检查法实际包含3个部分的实验,分别为:培养基适用性检查、方法适用性试验和供试品的无菌检查。
培养基适用性检查:主要目的有两个,一是确认使用的培养基本身是无菌的,即无菌性检查,通过在适宜温度下放置培养基观察判定;二是确认使用的培养基细菌或真菌是可以舒舒服服生长并且在规定时间内可以被观察到,即灵敏性检查,通过接种特定菌种,观察菌生长状态判断。进行了以上实验,就可以判断检测不到细菌真菌,不是培养基自身造成的。
方法适用性试验:主要目的是判断采用的方法,薄膜过滤法或者直接接种法,是否适用于你要检测的这种产品。尤其是一些产品,本身就含有抑菌成分,这种情况下难道在整个检验期内结果呈现阴性,就是真的无菌了吗?答案是不一定的,因此我们需要排除检验过程中操作或者产品本身的抑菌性。当一个新产品进行无菌试验或者实验条件改变时,需要进行验证试验,可与供试品无菌检查同步进行。
供试品的无菌检查:这就是实打实的对于产品的无菌检测,从检测数量、检验量、阴/阳性对照、接种要求、培养观察和结果判读全都进行了细致规定。谈谈检测数量和检验量,检测数量是一批次一定数量的产品中需要抽检的数量,检验量是每瓶/支中要取多少体积的供试品用于检测。对于检测数量和检测量的规定更好更全面地评估了整批样品的无菌性。
▲表1-无菌检查法药典包含项目或规定
▲表2-无菌检查法各国药典章节
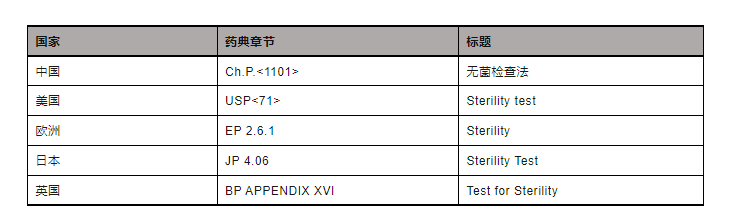
关于无菌检查法,美国、日本、欧洲药典等基本实现药典协调,因此本文着重以中美之间的差异为切入点进行分析:
1、菌种差异
用于无菌检测的“官方菌”,虽然各国采用的种类大致相同,但菌种往往带有独特的ID编号。拿中国来说,“中国医学细菌保藏管理中心(CMCC)”为主流机构,而欧美国家则普遍认可“美国标准菌种保藏中心(ATCC)”、“法国巴斯德研究所菌种保藏中心(CIP)”、“英国菌种保藏中心(NCTC)”、“日本菌种保藏中心(NBRC)”和“英国食品工业与海洋细菌菌种保藏中心(NCIMB)”,下列出不同药典要求的菌株编号:
▲表3-无菌检查法药典包含项目或规定
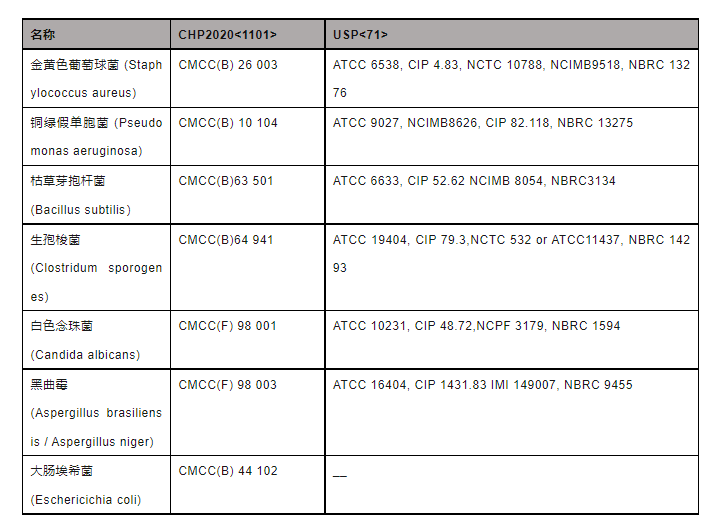
如何判断不同的编号和机构的同一种菌具有等效性呢?如何开展相关的验证实验?这一点其实没有明确的定论。

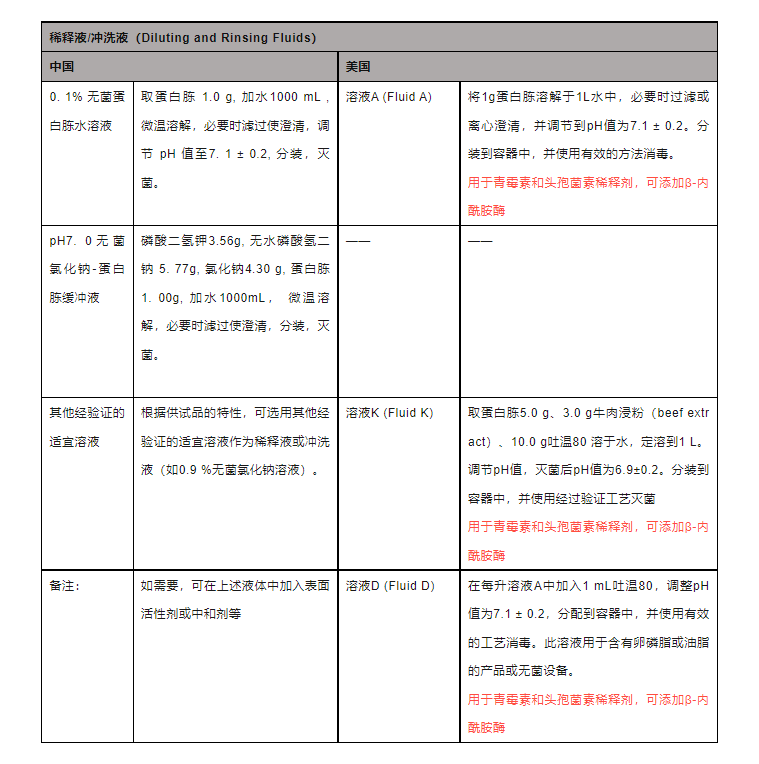
2、稀释液/冲洗液
通过对中美药典的对比,不难发现中美的稀释液和冲洗液存在差异。稀释液或冲洗液用于薄膜过滤法,美国药典列出了3种不同的稀释液,分别为溶液A,溶液D,溶液K。溶液A和中国药典的0.1%无菌蛋白胨水溶液配方是一致的。而溶液D为溶液A额外添加表面活性剂,实际上符合中国药典“如有需要,可在上述溶液中添加表面活性剂或中和剂”。另外,中国药典并没有锁死稀释液/冲洗液类型,那么如果美国溶液K经验证后,不对无菌检查法造成影响,是否也能得到中国药典的认可?溶液K主要可用于油剂和油性溶剂的稀释,而中国药典中对于非水溶性供试品的规定为“取规定量,直接过滤;或混合溶于适量含Tween80或其他适宜乳化剂的稀释液中”。虽然不少文章或研究对用于非水溶性供试品检测的稀释液进行改进,如使用磷酸盐溶液、摸索Tween80浓度梯度等,但笔者认为,如现有稀释液可满足方法适用性,则应该使用药典上明确规定的稀释液。
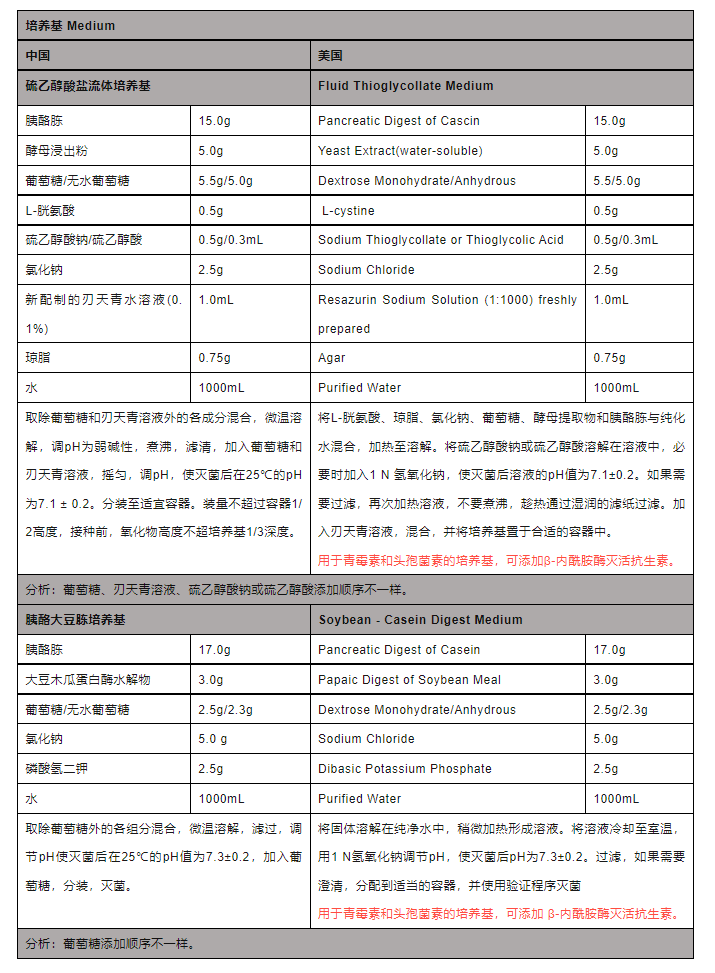
3、培养基差异
而主要培养基,硫乙醇酸盐流体培养基和胰酪大豆胨培养基,虽然中美药典要求大致相似,但仍需要注意细节问题。
4、汇总对比分析
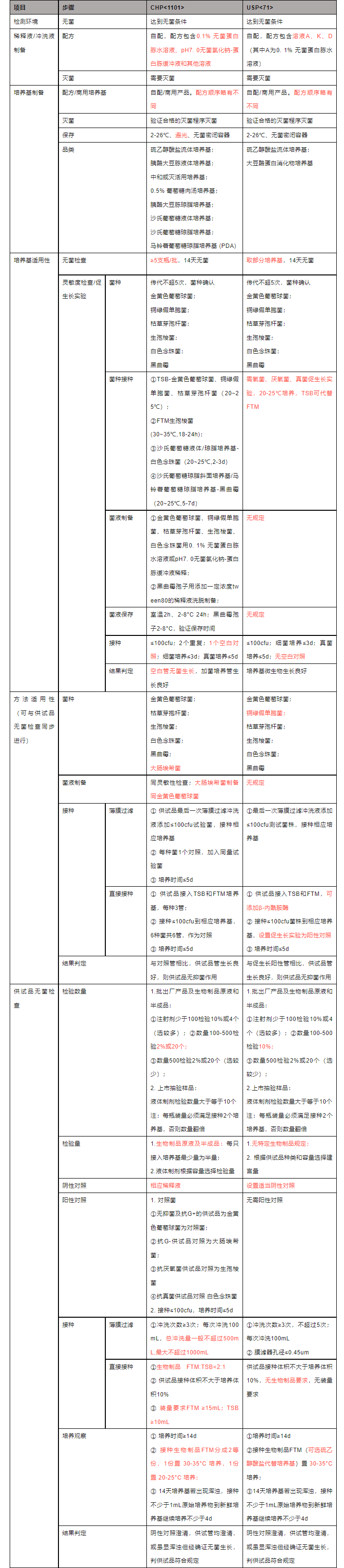
本文介绍了无菌检查法,并对比分析了该方法在各国药典中的规定。出于一些考虑,中国药典的无菌检查法暂时没有和国际统一,这对于药品双报或多报的企业来说就有了更多的挑战,按不同的药典要求建立符合注册国的无菌检查法对于注册而言可能更加稳妥。在这里也提出一些展望,现行的无菌检查法周期过长,开发出合理靠谱的无菌快速检测技术意义非凡,期待那一天早日到来。
药典协调之路道阻且长,药企应因地制宜做好充分准备。作者水平有限,文中内容难免疏漏,望广大同仁批评指正。
声明:文章转载于【注册圈】,作者【伊文斯】,文章版权归原作者所有,本文仅做转载分享~